A Química é a ciência que estuda a
constituição da matéria, sua estrutura interna, as relações
entre os diversos tipos de materiais encontrados na natureza, além de determinar
suas propriedades, sejam elas físicas – como, por exemplo, cor, ponto de fusão,
densidade, etc. – ou químicas, que são as transformações de uma substância em
outra.
A. Matéria, Corpo e Objeto
Chamamos matéria a tudo que tem massa, ocupa
lugar no espaço e pode, portanto, de alguma forma, ser medido. Por exemplo:
madeira, alumínio, ferro, ar, etc.
Corpo é uma porção limitada da
matéria e objeto é um corpo fabricado para um
determinado fim.
Resumindo, podemos dizer que o ferro é matéria, uma barra
de ferro é um corpo e um portão de ferro é um objeto.
B. Propriedades da Matéria
A matéria apresenta várias propriedades que são classificadas
em gerais, funcionais e específicas.
I. Propriedades Gerais da Matéria
São comuns a toda e qualquer espécie de matéria,
independentemente da substância de que ela é feita. As principais são: massa,
extensão, impenetrabilidade, divisibilidade, compressibilidade e elasticidade.
• Massa
Todos os corpos possuem massa.
• Extensão
Todos os corpos ocupam lugar no espaço.
• Impenetrabilidade
Dois corpos não ocupam, ao mesmo tempo, um mesmo lugar no
espaço.
• Divisibilidade
Os corpos podem ser divididos em partes cada vez menores.
• Compressibilidade
Os corpos possuem a propriedade de poder diminuir de tamanho,
sob a ação de forças externas.
• Elasticidade
Os corpos possuem a propriedade de voltar à forma e volume
originais, cessada a causa que os deformou.
II. Propriedades Funcionais da Matéria
São propriedades observadas somente em determinados grupos de
matéria. Esses grupos são chamados funções químicas, e as principais são:
ácidos, bases, sais e óxidos que serão estudados oportunamente.
III. Propriedades Específicas da Matéria
São propriedades que permitem identificar uma determinada
espécie de matéria. Dentre as propriedades específicas, podemos citar:
– Propriedades físicas: ponto de fusão, ponto de ebulição,
densidade.
– Propriedades organolépticas: odor,
sabor.
– Propriedades químicas: reações químicas.
C. Estados Físicos da
Matéria
1 – Estado Sólido: as
substâncias apresentam formas definidas e seu volume não varia de forma
considerável com variações de temperatura e pressão.
As partículas que constituem o sólido encontram-se ligadas uma
às outras de modo que não podem movimentar-se livremente.
2 – Estado Líquido: as
partículas que constituem o estado líquido não estão unidas fortemente, visto
que deslizam uma sobre as outras, adaptando-se à forma do recipiente que as
contém, mas estas forças de atração entre as partículas são suficientemente
fortes para que não ocorra variação no volume e as partículas dificilmente podem
ser comprimidas.
3 – Estado Gasoso: as
substâncias apresentam densidade menor que a dos sólidos e líquidos, ocupam todo
o volume do recipiente que as contém, podem expandir-se indefinidamente e são
comprimidas com grande facilidade. Este comportamento pode ser explicado pelas
forças de atração entre as partículas muito fracas as quais possuem, portanto,
alta mobilidade.
D. Mudanças de Estado
Fusão: passagem do estado sólido
para o líquido.
Solidificação: passagem do
estado líquido para o sólido.
Ponto de Fusão:
é a temperatura constante na qual um sólido se transforma num líquido.
Os pontos de fusão e solidificação ocorrem numa mesma
temperatura.
Vaporização: é a passagem do
estado líquido para o estado gasoso. A vaporização pode ocorrer de três formas:
evaporação, calefação e ebulição.
Condensação: é a passagem do estado gasoso para o estado
líquido. A condensação de um gás para o estado líquido é denominada de
liquefação.
Ponto de Ebulição: é a
temperatura constante na qual um líquido passa para o estado
gasoso.
Sublimação: é passagem do estado sólido
diretamente para o estado gasoso.
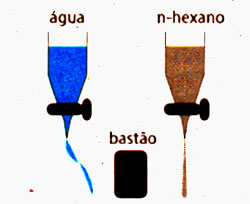
E. Densidade
É a relação entre massa (em gramas) de uma amostra de matéria e
o volume (geralmente em cm3) ocupado por esta amostra.
Quando dizemos que um material é mais denso que o outro,
significa que, comparando-se volumes iguais de ambos, o mais denso é o que
possui maior massa
 - cuja fórmula estrutural é O=O
- cuja fórmula estrutural é O=O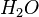 - cuja fórmula estrutural é H-O-H
- cuja fórmula estrutural é H-O-H (óxido nitroso) - um dos nitrogênios faz uma ligação covalente coordenada com o oxigênio.
(óxido nitroso) - um dos nitrogênios faz uma ligação covalente coordenada com o oxigênio.










